الفيزياء الذرية

الجزء الاول
▪️طيف الذرة
▪️Atomic Spectra
•أن الطيف الكهرومغناطيسي المنبعث من الذرة له من الأهمية في علم الفيزياء الذرية في التعرف على العناصر المختلفة ، حيث أن لكل عنصر من العناصر الموجودة في الطبيعة له طيف كهرومغناطيسي خاص به ولا يوجد عنصرين لهما نفس الطيف . ولدراسة الطيف الكهرومغناطيسي نحتاج إلى تحليل الضوء المنبعث من أثارة ذرات العنصر اما بواسطة المنشور prism أو بواسطة محزز الحيود . diffraction grating
•الطيف الكهرومغناطيسي يكون اما طیف متصل continuous spectrum " حيث يكون نتيجة تحليل الضوء الحصول على الوان الطيف التي تنتقل تدريجيا من لون إلى أخر بدون انقطاع " .
•وإما أن يكون طیف خطي Line Spectrum " يحتوي على مناطق لونية منفصلة تظهر على شكل خطوط " . ولقد ركز العلماء على دراسة الطيف المنبعث من ذرة الهيدروجين لسبب أن ذرة الهيدروجين ابسط ذرة لاحتواءها على الكترون واحد وان الهيدروجين المكون الرئيسي للكون.
• ركز العلماء على دراسة طيف ذرة الهيدروجين و توالت في هذا المجال حيث رصد العالم Balmer في العام 1885 الطيف المرئي لذرة الهيدروجين وهي الأنتقالات التي يحدثها الإلكترون إلى المستوى 2 = n .
وقد وضع العالم Balmer معادلة لحساب الاطوال الموجية لهذه المجموعة من طيف الذرة الهيدروجين وهي نتجت من تحليل النتائج العلمية
• هناك مجموعة أخرى من طيف ذرة الهيدروجين اكتشفها العالم Lyman وهي في مدی الأشعة فوق البنفسجية واكتشف العالمان Paschen , Bracket مجموعتين اخرتين في مدى الأشعة تحت الحمراء من الطيف الكهرومغناطيسي . ووضعت العديد من المعادلات التي تحسب هذه المجموعات من الأطوال الموجية وفي العام 1890 توصل العالم Rydberg إلى معادلة واحدة لحساب كل الأطوال الموجية لكل الأنتقالات المتوقعة من الذرة .
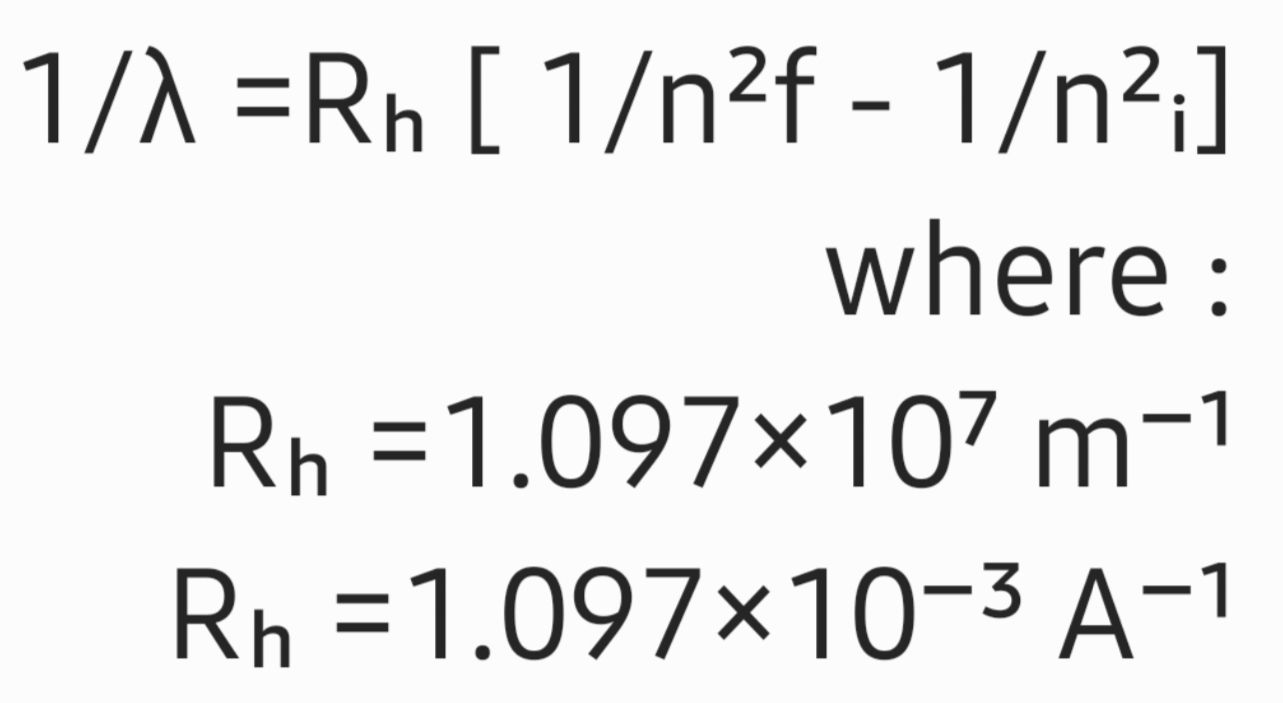
كُتبت المقالة من قبل / مهند قاسم



